您现在的位置是:生活百科网 > 生活百科 >
新制氢氧化铜(新制氢氧化铜与乙醛反应)
2022-05-16 15:36生活百科 人已围观
简介关于新制氢氧化铜新制Cu(OH)2有较强的还原性,可以和醛基发生反应.如将新制Cu(OH)2与乙醛一起加热,会产生砖红色沉淀Cu2O.竞赛的化可能还会讨论到产生Cu2(OH)2CO3也许是运气,今天我们的老师...
关于新制氢氧化铜
新制Cu(OH)2有较强的还原性,可以和醛基发生反应.如将新制Cu(OH)2与乙醛一起加热,会产生砖红色沉淀Cu2O.
竞赛的化可能还会讨论到产生Cu2(OH)2CO3也许是运气,今天我们的老师刚讲过这个问题.
这个没有错误.检验牙膏中的甘油时,用到氢氧化铜,制备方法是向硫酸铜里加几滴氢氧化钠.因为这个反应不是象检验醛基那样要求苛刻.而检验醛基时,因为生成羧酸,所以为防止羧酸与氢氧化铜反应使得现象不如正常时出现的砖红色沉淀,氢氧化钠必须过量,所以检验醛基时,氢氧化铜制备方法:在氢氧化钠溶液中滴加硫酸铜溶液,保证溶液呈碱性.实验化学书上检验牙膏中的甘油时,用到氢氧化铜,制备方法是向硫酸铜里加几滴氢氧化钠,实验只需要有氢氧化铜与甘油反应出现绛蓝色即可.氢氧化铜会变质生成氧化铜。
CU(OH)2=CUO+H2O
新制氢氧化铜溶液与氢氧化铜溶液的区别?
现代仪器
1. 核磁共振仪:有机物中处于不同化学环境的氢原子种类;
2. 红外光谱仪:主要测定有机物中官能团的种类;
3. 紫外光谱仪:有机物中的共轭结构(主要指苯环);
4. 质谱仪:有机物的相对分子质量,对测定结构也有一定的帮助;
5. 原子吸收(发射)光谱仪:测定物质的的金属元素,也可测定非金属元素;
6. 分光光度计:测定溶液中物质的成分以含量,重点是测反应速率;
7. 色谱分析仪:利用不同物质在固定相和流动相中分配比的不同,对物质进行分离,主要分类物理性质和化学性质相近的物质,纸层析就是其中的一种;
8. 李比希燃烧法:测定有机物中C、H、O、N、Cl的有无及含量,CO2、H2O、N2、HCl;
9. 铜丝燃烧法:测定有机物中是否含卤素,火焰为绿色说明含有卤素;
10. 钠熔法:测定有机物是否含有X、N、S,NaX、Na2S、NaCN;
11. 元素分析仪:测定物质中元素的种类;
12. 扫面隧道显微镜:观察、操纵物质表面的原子和分子;
化学史
1. 道尔顿:提出原子学说;
2. 汤姆生:在阴极射线实验基础上提出“葡萄干面包式”模型;
3. 卢瑟福:在α粒子散射实验基础上提出“核+电子”模型;
4. 波尔:在量子力学基础上提出轨道模型;
5. 舍勒:发现氯气;
6. 维勒:人工合成尿素;
7. 门捷列夫:元素周期表;
材料及成分
1. 火棉:纤维素与硝酸完全酯化的产物;
2. 胶棉:纤维素与硝酸不完全酯化的产物;
3. 人造丝、人造毛、人造棉、黏胶纤维、铜氨纤维主要成分都是纤维素;
4. 醋酸纤维:纤维素与醋酸酐酯化后的产物;
5. 光导纤维:成分为SiO2,全反射原理;
6. Al2O3:人造刚玉、红宝石、蓝宝石的主要成分;
7. SiO2:硅石、玻璃、石英、玛瑙、光纤的主要成分;
8. 硅酸盐:水泥、陶器、瓷器、琉璃的主要成分;
9. 新型无机非金属材料:氧化铝陶瓷、氮化硅陶瓷、碳化硼陶瓷、光纤等;
具有耐高温、强度大的特性,还具有电学特性、光学特性、生物功能;
10. 传统无机非金属材料:水泥、玻璃、陶瓷;
11. 新型高分子材料:高分子膜、尿不湿、隐形眼镜、人造关节、心脏补片、液晶材料等;
12. 三大合成材料:合成塑料、合成纤维、合成橡胶;
能源问题
1. 石油:烷烃、环烷烃、芳香烃的混合物
石油的分馏是物理变化,石油的裂化、裂解都是化学变化
2. 煤:主要成分是碳
煤的干馏、气化、液化都是化学变化;
3. 生物质能:通过光合作用,太阳能以化学能的形式贮藏在生物质中的能量形式;
木材、森林废弃物、农业废弃物、植物、动物粪便、沼气等;
4. 新能源:太阳能、风能、潮汐能、氢能、核能;
环境问题与食品安全
1. 臭氧层空洞:氟利昂进入平流层导致臭氧减少;
2. 温室效应:大气中CO2、CH4增多,造成全球平均气温上升;
3. 光化学烟雾:NxOy在紫外线作用下发生一系列的光化学反应而生成的有毒气体;
4. 赤潮:海水富营养化;
5. 水华:淡水富营养化;
6. 酸雨:pH<5.6;
7. 室内污染:HCHO、苯、放射性氡、电磁辐射;
8. PM2.5:直径≤2.5μm(2.5×10-6m)能在空中长时间悬浮,颗粒小,表面积大,能吸附大量有害有毒物质(如金属、微生物);
雾霾天气的形成于部分颗粒在空气中形成气溶胶有关
9. 非法食品添加剂:吊白块、苏丹红、三聚氰胺、硼酸、荧光增白剂、瘦肉精、工业明胶;
10. 腌制食品:腌制过程中会产生亚硝酸盐,具有致癌性;
11. 地沟油:地沟油中有黄曲霉素,具有致癌性;可以制肥皂盒生物柴油;
12. 绿色化学:绿色化学是指化学反应及其过程以“原子经济性”为基本原则,即在获取新物质的化学反应中充分利用参与反应的每个原料原子,实现“零排放”。绿色化学的目标是研究和寻找能充分利用的无毒害原料,最大限度地节约能源,在化工生产的各环节都实现净化和无污染的反应途径;
糖 类
1. 单糖:
丙糖:甘油醛(最简单的糖)CH2(OH)CH(OH)CHO
戊糖:核糖、脱氧核糖;
己糖:葡萄糖、半乳糖、果糖;
2. 二糖:
分子式
名称
有无醛基
水解产物
蔗糖
无
葡萄糖+果糖
C11H22O11
麦芽糖
有
葡萄糖+葡萄糖
同分异构体
乳糖
有
葡萄糖+半乳糖
纤维二糖
有
葡萄糖+葡萄糖
3. 多糖:
①淀粉(C6H10O5)n和纤维素(C6H10O5)n,n值是一个区间,故两者不是同分异构体,都是混合物;
②判断淀粉水解程度的方法 (在酸性条件下水解)
a.尚未水解:必须先加NaOH中和硫酸,再加入新制氢氧化铜加热,无砖红色沉淀;
b.完全水解:加入碘水,不呈蓝色
c.取两份,一份加入碘水呈蓝色;一份加入NaoH中中和硫酸后,再加入新制氢氧化铜加热,有砖红色沉淀
③人体中无纤维素酶,不能消化纤维素,多吃含纤维素食物可促进肠道蠕动;
氨基酸和蛋白质
1. α-氨基酸:氨基和羧基连在同一个碳上
天然蛋白质水解生成的氨基酸都是.α-氨基酸;
2. 两性:-NH2具有碱性,-COOH具有酸性
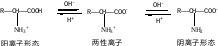
固体氨基酸主要以内盐形式存在,所以具有较高的熔沸点,且难溶于有机溶剂;
两个不同的氨基酸缩合形成二肽,有四种不同的产物(两个自身,两个交叉);
3. 分离:当氨基酸以两性离子存在于溶液中时,其溶解度最小,而不同的氨基酸出现这种情况的pH各不相同,故可利用此差异,通过调节溶液的pH值来分离氨基酸;
4. 盐析:许多蛋白质在水中有一定的溶解度,溶于水形成胶体;
在浓度较高的低盐金属盐(Na2SO4)或铵盐中,能破坏胶体结构而使蛋白质溶解度降低,从而使蛋白质变成沉淀析出,析出的蛋白质仍具有生物活性;
5. 变质:
①重金属盐、强酸、强碱、甲醛、酒精等可使蛋白质变性而失去活性,析出的蛋白质不再溶于水;
②当人体误食重金属盐时,可喝大量的牛奶、豆奶、鸡蛋清来解毒;
③酒精消毒是破坏了病毒的蛋白质活性而杀死病毒;
6. 颜色反应:
①蛋白质遇双缩脲试剂呈玫瑰紫色;
②含苯环的蛋白质与浓硝酸作用生成黄色物质;
③氨基酸遇茚三酮呈紫色;
7. 氢键存在:
①蛋白质的二级结构;
②DNA双螺旋结构,AT之间两条,CG之间三条;
油 脂
1. 油脂不是高分子,是由高级脂肪酸与甘油形成的酯类;
2. 油:不饱和脂肪酸甘油酯,常温液态,如豆油、花生油;能使溴水退色;不能从溴水中萃取溴单质;
3. 脂肪:饱和脂肪酸甘油酯,常温固态,如猪油、牛油油;
4. 皂化反应:油脂与碱反应生成甘油与高级脂肪酸钠;
5. 油脂硬化:不饱和高级脂肪酸甘油酯与氢气反应生成饱和高级脂肪酸甘油酯
6. 油脂和矿物油不是同一物质,矿物油是烃类;
7. 天然的油脂都是混合物;
8. 硬水中有较多的Mg2+、Ca2+,会生成不溶于水的(C17H35COO)2Mg和(C17H35COO)2Ca,使肥皂的消耗量增加,故不宜在硬水中使用肥皂;
9. 不饱和脂肪酸甘油酯中的双键会被空气氧化而变质;
10. 地沟油和人造奶油都是油脂;
化学中的不一定
1. 原子核不一定都是由质子和中子构成的。如氢的同位素(11H)中只有一个质子。
2. 酸性氧化物不一定都是非金属氧化物。如Mn2O7是HMnO4的酸酐,是金属氧化物。
3. 非金属氧化物不一定都是酸性氧化物。如CO、NO都不能与碱反应,是不成盐氧化物。
4. 金属氧化物不一定都是碱性氧化物。如Mn2O7是酸性氧化物,Al2O3是两性氧化物。
5. 电离出的阳离子都是氢离子的不一定是酸。如苯酚电离出的阳离子都是氢离子,属酚类,不属于酸。
6. 由同种元素组成的物质不一定是单质。如金刚石与石墨均由碳元素组成,二者混合所得的物质是混合物;由同种元素组成的纯净物是单质。
7. 晶体中含有阳离子不一定含有阴离子。如金属晶体中含有金属阳离子和自由电子,而无阴离子。
8. 有单质参加或生成的化学反应不一定是氧化还原反应。如金刚石→石墨,同素异形体间的转化因反应前后均为单质,元素的化合价没有变化,是非氧化还原反应。
9. 离子化合物中不一定含有金属离子。如NH4Cl属于离子化合物,其中不含金属离子。
10. 与水反应生成酸的氧化物不一定是酸酐,与水反应生成碱的氧化物不一定是碱性氧化物。如NO2能与水反应生成酸—硝酸,但不是硝酸的酸酐,硝酸的酸酐是N2O5,Na2O2能与水反应生成碱—NaOH,但它不属于碱性氧化物,是过氧化物。
11. pH=7的溶液不一定是中性溶液。只有在常温时水的离子积是1×10-14,此时pH=7的溶液才是中性。
12. 用pH试纸测溶液的pH时,试纸用蒸馏水湿润,测得溶液的pH不一定有误差。
13. 分子晶体中不一定含有共价键。如稀有气体在固态时均为分子晶体,不含共价键。
14. 能使品红溶液褪色的气体不一定是SO2,如Cl2、O3均能使品红溶液褪色。
15. 金属阳离子被还原不一定得到金属单质。如Fe3+可被还原为Fe2+。
16. 某元素由化合态变为游离态时,该元素不一定被还原。如2H2O=2H2↑+O2↑,氢元素被还原而氧元素被氧化。
17. 强氧化物与强还原剂不一定能发生氧化还原反应。如浓硫酸是常见的强氧化剂,氢气是常见的还原剂,但可用浓硫酸干燥氢气,因二者不发生反应。
18. 放热反应在常温下不一定很容易发生,吸热反应在常温下不一定不能发生。如碳与氧气的反应为放热反应,但须点燃;Ba(OH)2·8H2O与NH4Cl反应为吸热反应,但在常温下很容易发生。
19. 含金属元素的离子不一定都是阳离子。如AlO2-、MnO4-。
20. 最外层电子数大于4的元素不一定是非金属元素。如周期表中ⅣA、ⅤA、ⅥA中的金属元素最外层电子数均多于4个。
21. 不能在强酸性溶液中大量存在的离子,不一定能在强碱性溶液中大量存在。如HCO3-、HS-等离子既不能在强酸性溶液中大量存在,也不能在强碱性溶液中大量存在。
22. 组成和结构相似的物质,相对分子质量越大,熔沸点不一定越高。一般情况下该结论是正确的,但因H2O、HF、NH3等分子间能形成氢键,熔沸点均比同主族元素的氢化物高。
23. 只由非金属元素组成的晶体不一定属于分子晶体。如NH4Cl属于离子晶体。
24. 只含有极性键的分子不一定是极性分子。如CCl4、CO2等都是含有极性键的非极性分子。
25. 铁与强氧化性酸反应不一定生成三价铁的化合物。铁与浓硫酸、硝酸等反应,若铁过量则生成亚铁离子。
26. 强电解质不一定导电;一般强电解质的晶体不导电;
27. 强电解质的导电性不一定强于弱电解质;与溶度有关;
28. 失去电子难的原子获得电子的能力不一定强。如稀有气体原子既不易失去电子也不易得到电子。

常考知识点的归纳
1. 主要成分是纤维素的物质
麻类、棉花、木棉、人造丝、人造毛、人造棉、铜氨纤维等;
干扰项:光导纤维、醋酸纤维、硝化纤维、火棉、胶棉;
2. 属于蛋白质的物质,水解得到氨基酸,燃烧有焦羽毛气味
动物毛发角蹄、蚕丝、血红蛋白、酶类、天然皮革;
干扰项:人造奶油;
3. 主要成分为油脂的物质
动物油、植物油、地沟油、人造奶油、鱼肝油、脂肪;
干扰项:矿物油;
4. 高分子物质
蛋白质、淀粉、纤维素、PVC、PLA、核酸、聚XX;
干扰项:油脂、维生素;
5. 能水解,且产物均为葡萄糖的物质
淀粉、麦芽糖、纤维二糖、纤维素;
6. 元素定性分析法
李比希燃烧法、钠熔法、铜丝燃烧法、元素分析仪、原子吸收(发射)光谱;
7. 测定有机物结构有作用
核磁共振、质谱、红外光谱
8. 原子结构模型的建立
①汤姆生:在阴极射线实验基础上提出“葡萄干面包式”模型;
②卢瑟福:在α粒子散射实验基础上提出“核+电子”模型;
③波尔:在量子力学基础上提出轨道模型;
干扰项:道尔顿:只是提出了原子的概念;
布朗运动:只能说明分子作无规则运动;
概 念
1. 电解质:在水溶液中或熔融状态下能够导电的化合物;
水、有机酸、无机酸、碱、盐、金属氧化物都是电解质
2. 非电解质:在水溶液中和熔融状态下都不能够导电的化合物;
3. 强电解质:在水溶液或熔融状态下完全电离的电解质;
强酸:HCl,H2SO4,HNO3,HI,HBr,HClO4等
强碱:KOH,NaOH,Ca(OH)2,Ba(OH)2等可溶性碱
绝大部分盐:CaCl2,CuSO4,Na2CO3,BaSO4,CaCO3等
干扰项:难溶性盐虽然溶解度小,但它是强电解质;
4. 弱电解质:在水溶液或熔融状态下部分电离的电解质;
弱酸:HAc,H2CO3,HF,HClO,H2SO3,H2S,H3PO4等;
弱碱:NH3H2O,Cu(OH)2Mg(OH)2等难溶性碱;
少部分盐:Pb(Ac)2,HgCl2
5. 碱性氧化物:能与酸反应,只生成盐和水的氧化物;
6. 酸性氧化物:能与碱反应,只生成盐和水的氧化物;
? 标签:知识汇总
相关文章
- 2023北京本科普通批985院校投档线:清华685、北大683、武大653分
- 广东考生上华南理工大学难吗?
- 上海这3所大学2023考研复试分数线公布
- 最大相差178分!南京理工大学投档线集锦!最高681分,最低503分
- 2023湖北物理类投档线:武科大573、湖大563、江大536、武体506分
- 多少分能上南大?2023南京大学在苏录取数据盘点,这些途径可以走
- 2023山东高考,省内分数线最高的十所大学
- 国防科技大学录取分数线是多少?附国防科技大学毕业去向
- 郑州大学多少分能考上?2024才可以录取?附最低分数线
- 北京航空航天大学2023年录取分数线及省排名
- 哈尔滨工业大学(威海)、(深圳)校区2023年录取分数情况
- 2023广东本科投档线出炉!请看中大/华工/深大/华师/暨大等分数线
随机图文

丝棉被脏了怎么洗(大的丝棉被怎么洗)
丝棉被脏了怎么洗这些被子好看是好看,好看也不行,你总不能不套被套直接盖...
秘密网(秘密网名)
秘密网摸鱼儿七月,大雨滂沱。万物嚣张,郁郁葱葱景色中,绿野升腾着浓郁的...
什么电视剧最好看(2022什么电视剧最好看)
从“猫眼专业版”实时数据显示可知,在截至晚上21时20分,网播热度最高的五...
施组词和拼音(施组词和拼音字)
每日一练一、二年级按照要求写句子。天上的星星在闪烁。(改为拟人句)__...
古装穿越剧(古装穿越剧2022最火的穿越剧)
天气转暖,剧组也开始忙碌起来了,去年没拍完的大剧早已经复工,新剧也陆续...
手淘搜索(手淘搜索流量怎么提高)
黑搜不是什么新鲜的东西,但是有的小伙伴可能觉得这玩意儿很神秘,始终理解...
考研成绩何时公布(考研成绩何时公布)
文/学个习距离心心念的2022考研初试成绩公布还有16天时间。根据部分省教育考...
自动阅读脚本(自动阅读软件脚本)
大家好,我是章鱼猫。今天推荐的这个项目是TiebaSignIn,这是一个利用githubact...
点击排行
 杭瑞高速公路起点终点及相关收费站点介绍
杭瑞高速公路起点终点及相关收费站点介绍